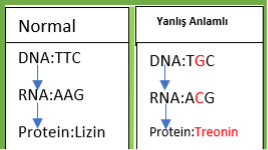
DNA’da aminoasit kodlayan bir kodun nükleotit mutasyonu sebebiyle başka bir aminoasitin koduna dönüşmesi.

DNA’da aminoasit kodlayan bir kodun nükleotit mutasyonu sebebiyle başka bir aminoasitin koduna dönüşmesi.
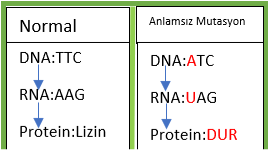
DNA sekansındaki nükleotit değişimi sebebiyle erken bir “dur” kodonu oluşması.
Önceki bölüm–> CRISPR-Cas9 Metodu-1: Genetikte Yeni Çağ
Cas-9 proteini ve hedefe göre tasarlanan gRNA’yı hücreye koyup çalışmasını sağlarsak, bu istediğimiz DNA bölgesini kesebileceğimiz anlamına gelir. Peki kesince ne olacak? DNA’da ikili kırık oluşturmak nasıl olur da genleri istediğimiz şekilde değiştirir? Şimdi bu dahice tasarlanan sürece daha yakından bakalım.
Paketin Teslimatı
İlgili genimizi belirledik. CRISPR sistemi için gerekli bileşenleri topladık. Sırada, CRISPR sistemini bir şekilde hücremize dahil edip onu çalıştırmak var.Bir ökaryotik hücreye CRISPR-Cas9 sistemini yüklemenin 3 farklı yolu var: vektör aracılı teslimat, direkt kompleks teslimatı ve RNA teslimatı (Şekil-1).
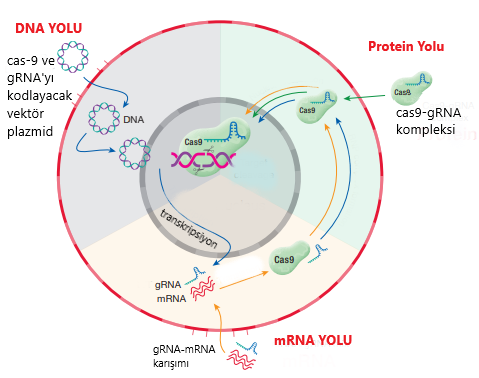
DNA yolunda, hücreye uygun bir ekspresyon vektörü seçilip buna cas operonu ve gRNA’yı kodlayacak DNA parçası ekleniyor. Daha sonra bu vektör hücreye veriliyor ve çekirdekte ekspresyonu gerçekleşiyor. Transkripsiyon sonucunda oluşan cas-9 mRNA’ları translasyonla proteinleri oluşturuyor. Oluşan cas-9’lar, gRNA’lar ile kompleks oluşturuyor ve gRNA nereyi gösterirse DNA’da o bölge iki zincirden kesiliyor. mRNA ve Protein yollarının DNA yolundan tek farkı ise ilk aşamaları atlamamız: mRNA yolunda direkt sentezlenmiş RNA’lar, protein yolunda ise sentezlenip gRNA ile son halini alan cas-9’ lar hücreye veriliyor(Şekil-1).
Peki, çift zincir kırıklarını oluşturduk. DNA’ ya böyle bir ciddi bir çift kırık hasarı vermenin bize nasıl bir faydası olabilir ki? Bu kırıklar, tek bir kromozomda oluşan bir kırık bile hücrenin ölümüne sebep olabilir1.İşte, güzel kısım burada, yine hücrenin normalde zaten sahip olduğu bir sistemi dahice kendi faydamıza kullanıyoruz: DNA ikili zincir kırık tamiri.
DNA Kırık Tamirleri
Şimdi, CRISPR’a biraz ara verip moleküler biyoloji bilgilerimizi tazeleyelim. İonize radyasyon, radyoaktif kimyasallar veya mekanik stres kromozomlarda kırıklara sebep olabilir2. Ökaryotik hücreler, kromozomlarında bir ikili zincir kırığı tespit ettiklerinde, bunu iki şekilde tamir edebilirler: Homolog rekombinasyon veya Non-homolog uç bağlanması.
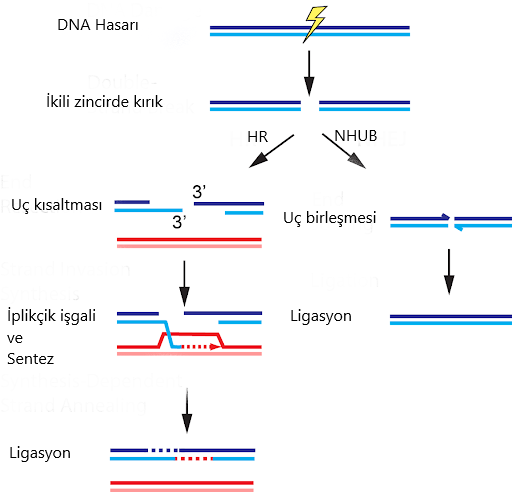
Non-Homolog Uç Bağlama(NHUB) Yolu
Bu yolda, hücre kırık uçları işleyerek tekrar ligasyon yapar(Şekil-2). Non-homolog denmesinin sebebi ise homolog rekombinasyon yolunun aksine, bu yolda kırık kromozomun homologu kalıp olarak kullanılmaz. Hücre iki ucu direkt ligasyon yapar. Ancak, bu yolun dezavantajı ise çoğu zaman hücre ortamında kırık uçlar tam olarak birbirine uyumlu kalmaz ve uçlardan bir kısım nükleotidlerin kaybı gerekir. Yani NHUB yolunda önce uçlardan bir kısım nükleotidler koparılıyor ve daha sonra kırık uçlar birleştiriliyor. Ancak biz biliyoruz ki tek bir nükleotid değişimi bile çok büyük hasarlara sebep olabiliyor (bkz. Orak hücreli anemi). Görünen o ki, bir DNA kırığının hücreye zararı çok daha fazla ve hücre zincir tamiri sebebiyle oluşan nükleotid kayıplarından kaynaklanacak problemleri göze alıyor.
Homolog Rekombinasyon (HR) Yolu
HR yolunda da hücre kırık uçları kısaltıyor ancak, bu kayıplar homolog kromozoma bakılarak tekrar sentezleniyor(Şekil-2). Homolog kromozomoun kalıp olarak kullanılması sayesinde, Non-homolog rekombinasyon aksine, hücrede gen fonksiyonunun kaybı ihtimali düşüyor. Ancak bu yolun muhtemel dezavantajlarından biri ise heterozigotluk kaybı. Bu şu demek; rastgele bir kromozomdaki rastgele bir gen lokusu için “Aa” heterozigot bir birey düşünelim. “A” allelini taşıyan kromozom lokusunda bir kırık oluşur ve hücre bu kırığı HR ile tamir ederse, kalıp olarak “a” allelini kullanacağı için, büyük ihtimalle baskın allel de “a”ya dönüşecek. İşte bir heterozigot bireyin homozigot bireye dönüşmesine heterozigotluk kaybı deniyor ve HR, bunun sebeplerinden biri.
Sebebini kesin olarak bilmiyoruz ancak memeli hücrelerinde NHUB yolu çok daha yaygın olarak gerçekleşiyor4. Bunun mantıklı bir sebebi ise, homolog kromozomlar sadece S ve G2 fazlarında kullanıma açık olacağından, HR yolunun sadece bu fazlarda kullanılması. Ancak NHUB için böyle bir sınırlama yok, hücrede her hangi bir anda kullanılabilir.
Peki biz bu tamir mekanizmalarını CRISPR-Cas9 sisteminde nasıl kullanacağız? Bu soruyu size bırakıyorum, bir sonraki yazıda cevabı öğreneceğiz.
Üçüncü bölümde, CRISPR-Cas9 sisteminde bu tamir mekanizmalarını kullanarak nasıl gen susturma, tamir ve fonksiyon kazanma gerçekleştirildiği incelenecek.
[1] Featherstone, C., Jackson, S.P. DNA double-strand break repair
[Internet] Elsevier. 21 October 1999. Available from:
https://www.cell.com/current-biology/comments/S0960-9822(00)80005-6
[2] Stephen P. Jackson, Sensing and repairing DNA double-strand breaks, Carcinogenesis, Volume 23, Issue 5, May 2002, Pages 687–696, Available from:
https://doi.org/10.1093/carcin/23.5.687
[3] Finkelstein, I. How do DNA repair proteins initiate double-strand breaks repair?[Internet] [ cited 15 January 2021]. Available from:
http://finkelsteinlab.net/research
[4] Davis AJ, Chen DJ. DNA double strand break repair via non-homologous end-joining. Transl Cancer Res. 2013 Jun;2(3):130-143. doi: 10.3978/j.issn.2218-676X.2013.04.02. PMID: 24000320; PMCID: PMC3758668.

2013 yılında, Feng Zhang ve arkadaşları tarafından Science dergisinde bir makale yayınlandı1. O zamanlar bilim dünyasında çığır açan bu makale, CRISPR/Cas adı verilen metodun ökaryotlardaki muhtemel uygulamaları üzerineydi. Bu sistemle, genleri kesebilir, istediğimiz parçaları ekleyebilir ve bu sayede birçok hastalığı tedavi edebilirdik.
Nedir bu dillerden düşmeyen CRISPR? Sokaktan geçen vatandaşlara sorsak, çoğunun duymuş olduğu, oldukça popüler bir konsept. Metodun bilim dünyasındaki etkisini, CRISPR yayınlarının 2013 ve sonrasındaki dramatik artışından da anlayabiliriz( Res-1).
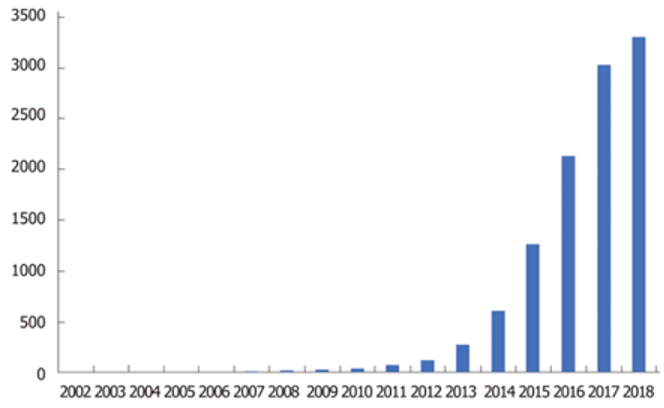
Biyolojide, devrim niteliğindeki çoğu buluşta olduğu gibi (bkz. RNAi), burada da yapılan şey, doğada zaten bulunan bir sistemi alıp bunu amacımıza göre tasarlayarak kullanmaktan ibaret.
CRISPR, “kümelenmiş düzenli aralıklı kısa palindromik tekrarlar” ın baş harflerine karşılık geliyor. Bakteriler ve arkelerin genomlarında bulunan bu tekrarlar, aslında kendilerini enfekte eden bakteriyofajların DNA parçaları. Bakteriler, bu parçalara bakarak, bir daha o virus saldırdığında, onu tanıyıp genetik materyalini yok ediyor3. Bir nevi fajlara karşı bağışıklık sistemi: Kaydet, Hazırlan, Saldır.
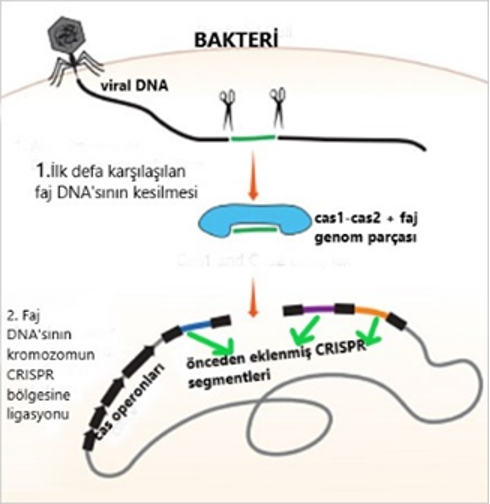
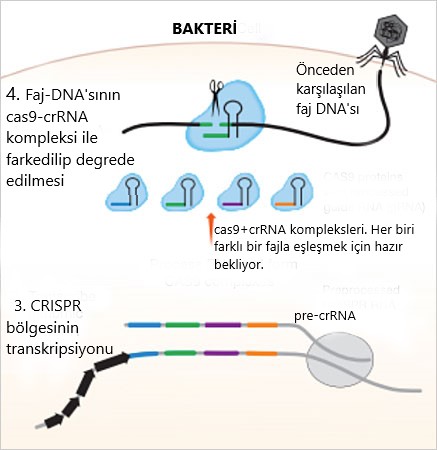
Cas, “CRISPR ilişkili diziler”in kısaltması. Hücrenin DNA’sında, bu operonlar, her birinin ayrı fonksiyonu olan cas proteinlerini üretiyor. Bakteri yeni bir fajla tanışınca, cas1-cas2 protein kompleksi, faj DNA’sının bir bölümünü bakteri kromozomuna entegre ediyor (Resim-2). Bakteri, çeşitli fajlardan topladığı bu parçaları(CRISPR dediğimiz sekanslar bunlar) kendi genomunda belli aralıklarla arka arkaya dizip, toplu bir şekilde transkribe ediyor. Bu transkript(pre-crRNA), daha sonra aynı şekilde küçük parçalar(crispr RNA’lar,crRNA) şeklinde işleniyor ve her crRNA, tracrRNA(trans aktivatör crispr RNA,Resim-2’de crRNA’lara bağlı tokalar şeklinde resmedilmiş) adlı başka bir tip RNA parçasıyla birleşip cas-9 proteini ile bir araya geliyor. Buradan sonra hücre, faj DNA’sı için pusuya yatıyor diyebiliriz. Faj DNA’sı bakteriye girdiğinde, eğer crRNA-DNA eşleşmesi meydana gelirse, cas-9 faj DNA’sını yıkıyor (Resim-3). TracrRNA ise katalitik süreci kolaylaştırmaktan sorumlu. TracrRNA+crRNA’ ya ise gRNA(rehberRNA) deniyor. Bu sistem sayesinde bakteri,önceden karşıılaştığı bir fajın saldırısını savuşturabiliyor.
Peki bilim adamları bu süreçte neyi farketti? 4.aşamaya tekrar bakalım (Resim-3). Cas-9, crRNA’nın eşleşme yaptığı DNA’yı iki zincirden kesiyor. Eğer biz değiştirmek istediğimiz genin RNA’sını crRNA olarak cas-9’ la birlikte hücreye sunabilirsek, cas9-crRNA kompleksi hücrenin içinde o geni bulup kesebilir mi?
İşte bilim insanları da bunu sordu. Cevabı ikinci bölümde…
[1] Cong L, Ran FA, Cox D, Lin S, Barretto R, Habib N, Hsu PD, Wu X, Jiang W, Marraffini LA, Zhang F. Multiplex genome engineering using CRISPR/Cas systems. Science. 2013 Feb 15;339(6121):819-23. doi: 10.1126/science.1231143. Epub 2013 Jan 3. PMID: 23287718; PMCID: PMC3795411. Arşiv linki için:
https://pubmed.ncbi.nlm.nih.gov/23287718/
[2] Harnessing the potential of gene editing technology using CRISPR in inflammatory bowel disease – Scientific Figure on ResearchGate. Available from: https://www.researchgate.net/figure/Number-of-CRISPR-publications-by-year_fig1_333091003 [accessed 10 Jan 2021]
[3] Barrangou,R. (2015). “The roles of CRISPR-Cas systems in adaptive immunity and beyond”. Current Opinion in Immunology. 32: 36–41. doi:10.1016/j.coi.2014.12.008. PMID 25574773.
[4] https://www.bio-rad.com/en-tr/applications-technologies/crispr-cas-gene-editing-teaching-resources?ID=Q58I0DWDLBV5 ‘den alındı.