Önceki bölüm: CRISPR-Cas9 Metodu-2 : Kargolama ve Tamir Mekanizması
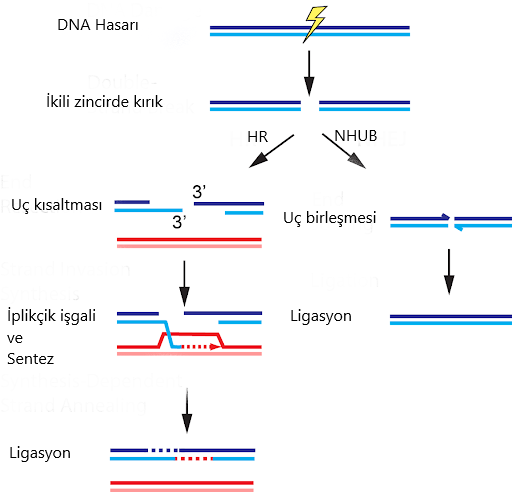
Önceki bölümlerde bahsettiğimiz gibi CRISPR-Cas9’ u hücreye aktarıp çalıştırdığımızda, DNA’da istediğimiz bölgede ikili kırık oluşacak. Daha sonra hücre, iki tamir mekanizmasından birini kullanarak tamir edecek. HR yolunda homolog kromozomdan tabiri caizse kopya çekerek kırık bölgeyi yeniden oluştururken NHUB yolunda uçlardan bir kısım nükleotidlerin kaybını göze alarak direkt uçları birbirine kaynaştırıyor.
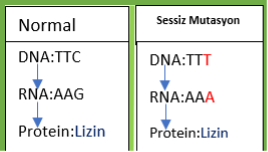
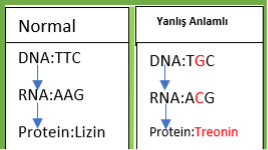
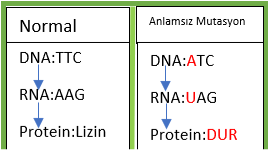
Aslında, hangi yolu isteyeceğimiz bizim gen üzerindeki çalışmamıza bağlı. Eğer genin fonksiyon kaybını istiyorsak(bkz. Gen nakavt), hücreyi direkt olarak NHUB’a yönlendirmek en mantıklısı. Böylece nükleotid kaybıyla gen dizisi bozulacak ve büyük olasılıkla anlamsız, yanlış anlamlı veya çerçeve kayması(eğer kaybolan nükleotid sayısı 3’ün katları değilse) mutasyonlarından biri meydana gelecek(Resim-1b). Şurada bir parantez açarak
söylemeliyim ki eğer ortamda o anda kırık uçlarla eşleşecek DNA parçaları varsa, random bir insersiyon da gerçekleşebilir, ancak bu da yine gen inaktivasyonuna sebep olacaktır. Sonuçta, gen ürünümüz yani proteinimiz artık fonksiyonel olmayacağından, bu proteinin işlevini gözlemleyebileceğiz. Diyelim ki bir genin fonksiyonunu öğrenmek istiyoruz. NHUB sonucunda varsayımsal bir A proteinin fosforilasyonu azaldıysa, hedef genin bu A proteinin fosforilasyonunu doğrudan ve ya dolaylı olarak arttırdığını söyleyebiliriz. Dahası, bu yolla hastalıkları tedavi edebiliriz. Eğer hücrede mutant bir protein varsa ve bunun eski fonksiyonunu kazanması yerine hücrede hiç bulunmaması daha avantajlıysa, bu geni NHUB yoluyla bozabilir ve böylece hücrenin hastalığa sebep olan proteinden kurtulmasını sağlayabiliriz (gen inaktivasyonu).
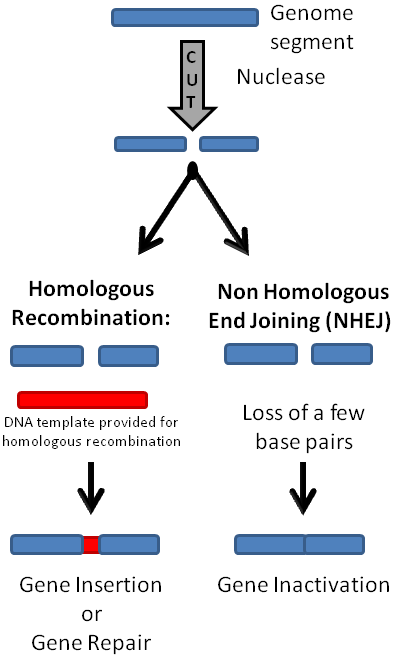
HR yolunda ise yapılan ise tasarladığımız kalıp DNA’yı hücreye vermek. Böylece, kalıp DNA’ yı nasıl tasarladıysak, gen bölgesini o şekilde değiştirebileceğiz. Mesela alıcının genomuna bir gen eklemek istiyoruz. Önce bu gen homolog kromozoma, kalıp DNA, ekleniyor ve daha sonra alıcı hücreye CRISPR-Cas9 sistemi ile birlikte veriliyor. Böylece, bu geni alıcının genomuna dahil edebiliyoruz. Örneğin, oldukça popüler bir protein olan yeşil floresan proteini(GFP) genini( normalde Aequoria victoria türü denizanasında bulunur) farelere CRISPR-Cas9 ile ekleyip yeşil ışık yaymalarını sağlayabiliriz( Resim-2). Ya da daha pratik uygulamalara bakalım. İnsan hücreleri için gerekli bir protein geninin eksikliğinden kaynaklı ölümcül bir hastalık düşünelim. Eğer, bu hastalığı embriyo döneminde teşhis edersek, CRISPR teknolojisi ile bu genin hücrelere ekleyebiliriz ve böylece o insanın yaşamasını sağlarız. Muhteşem değil mi?

Ya da, silinmiş bir geni eklemek yerine, hastalığa sebep olan mutant bir geni yabani tip(wild-type) versiyonuna dönüştürebiliriz. Tek yapmamız gereken aynı şekilde uygun CRISPR-Cas9’u ve yabani tip alleli taşıyan kalıp kromozomu hücreye vermek. Sonrasını siz de tahmin ediyorsunuzdur ancak yine de tekrar edelim. Önce, cas proteini gRNA’nın kendisini gösterdiği yeri, yani hedef gen bölgesini kesecek. Ardından, hücre bu kırığı bizim verdiğimiz ve yabani tip alleli taşıyan kromozoma bakarak düzeltecek. Böylece, mesela varsayımsal bir lokus için aa genotipli bir bireyi Aa yapıp fenotipini değiştirebiliriz. Burada son aşamaya dikkatinizi çekmek istiyorum. Hücre nasıl oluyor da kırığı kendi “a” homolog kromozomuna bakarak değil de, bizim dışarıdan verdiğimiz “A” kromozomuna bakarak tamir ediyor? Dahası, önceki yazılarda da bahsetmiştik, memeli hücrelerinde NHUB yolu çok daha yaygın. Nasıl bir yol izlemeliyiz ki hücreyi hem HR yoluna hem de HR’de bizim dışarıdan verdiğimiz kromozomu kullanmaya itelim?
Öncelikle, memeli hücrelerinin neden NHUB yolunu daha sık kullandıklarına bakalım. Bunun aslında pratik bir sebebi var. Homolog kromozomlar sadece S ve G2 fazlarında kullanıma açık olacağından, HR yolunun sadece bu fazlarda kullanılabilir. Yani, hücrenin elinin altında her zaman hazır bir homolog kromozom yok. Ancak NHUB için böyle bir sınırlama yok, hücre her hangi bir anda bu yolu kullanabilir. Çekirdeğin içinde diğer homolog kromozomun bulunması nispeten daha uzun süreli ve muhtemelen de daha çok enerji gerektiren bir süreç. Oldukça mantıklı bir diğer sebep ise, memelilerin genom içeriğiyle alakalı. Memeli genomunun büyük bir içeriğini tekrar eden diziler oluşturuyor. Benzer dizilerden fazlaca bulunması, hücrenin HR yolunda yanlış bir bölgeyi kalıp kullanmasına sebep olabilir. NHUB yolu ise bir birine çok yakın, muhtemelen az önce kırılmış iki ucu bir araya getirmede rol oynuyor. NHUB yolunun HR yolunu baskılaması ve hücre içinde daha hızlı gerçekleşmesi ise NHUB’un bu kadar sık görülmesinin diğer sebepleri olarak sayılabilir3.
Hücrenin NHUB yolunu seçmek için böyle sebepleri var ancak biz dışarıdan müdahale ile HR yolunun gerçekleşme ihtimalini arttırabiliriz. Eğer, tasarladığımız kalıp kromozomdan onbinlerce kopyayı hücreye verirsek, HR yolunu uyarabiliriz. Homolog kromozom artık kolayca ulaşılabilir olduğundan, HR yolunun ihtimali artacaktır. Aynı zamanda, tasarlanan kromozomdan onbinlerce verdiğimizden, HR yolunda hücre kendisindeki homolog kromozoma erişmekte zorlanacak (bir tane olduğu için) ve dışarıdan verilen kalıbı kullanacaktır. Yapabileceğimiz diğer bir metod, hücrede NHUB yolunun gerçekleşmesini engellemektir. Araştırmacılar, bu yolda gerekli olan bir Ligaz proteinini inhibe ettiler ve bunun sonucunda HR yolunun daha çok gerçekleştiği gözlendi4. Diğer bir araştırmada ise, HR yolu ile ilişkili bir proteinin stimulasyonu, HR frekansını arttırdı.5 HR yolunu inhibe eden ve uyaran proteinler üzerine çalışmalar umut verici ve gelecekte oldukça popüler olacağa benziyor.
CRISPR-Cas9 sisteminin kökeninden, nasıl hücreye yerleştireceğimizden, dezavantajlarından ve bunları nasıl avantaja dönüştüreceğimizden bahsettik. Ne tesadüftür ki tam da CRISPR hakkında yazmayı planladığım sıralarda, 2020 Nobel ödülleri açıklandı. Kimya dalında ise CRISPR sisteminin ökaryotlardaki kullanımı üzerine öncü çalışmalarından dolayı Emmanuelle Charpentier ve Jennifer Doudna kazanan oldu.Çalışmaları hakkında detaylı linki Kaynak kısmına bırakıyorum6. Her şeyi hesaba kattığımızda, Gen düzenleme, özellikle CRISPR aracılı gen düzenleme gelecekte biyoteknolojinin ve gen terapisinin en gözde konusu olacak gibi duruyor.
Kaynaklar ve İleri Okuma
[1] King, D. The CRISPR/Cas9 System and its Applications [Internet] Cell Culture
Dish 16 May 2016. Available from:
https://cellculturedish.com/the-crispr-cas9-system-and-its-applications/
[2] retrieved from:
[3] Yang H, Ren S, Yu S, Pan H, Li T, Ge S, Zhang J, Xia N. Methods Favoring Homology-Directed Repair Choice in Response to CRISPR/Cas9 Induced-Double Strand Breaks. International Journal of Molecular Sciences. 2020; 21(18):6461.
[4] Improving CRISPR-induced homologous recombination. Nat Methods 12, 388 (2015). https://doi.org/10.1038/nmeth.3375
[5] Nambiar, T.S., Billon, P., Diedenhofen, G. et al. Stimulation of CRISPR-mediated homology-directed repair by an engineered RAD18 variant. Nat Commun 10, 3395 (2019). https://doi.org/10.1038/s41467-019-11105-z
[6] https://www.nobelprize.org/prizes/chemistry/2020/press-release/